Hydroxyproline
| Hydroxyproline | |
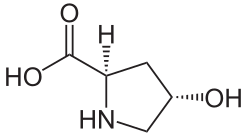
 Structure de la trans-4-hydroxy-L-hydroxyproline |
|
| Identification | |
|---|---|
| Nom UICPA | (4R)-4-hydroxy-L-proline |
| Synonymes |
acide (2S,4R)-4-hydroxy-2-pyrrolidinecarboxylique |
| No CAS | |
| No ECHA | 100.000.084 |
| No CE | 200-091-9 |
| No RTECS | TW3586500 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H9NO3 [Isomères] |
| Masse molaire[1] | 131,129 9 ± 0,005 7 g/mol C 45,8 %, H 6,92 %, N 10,68 %, O 36,6 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'hydroxyproline, ou (2S,4R)-4-hydroxyproline (abrégé en Hyp dans PDB), est un acide aminé dérivé de la proline par hydroxylation. Elle fait donc partie, comme cette dernière, de la famille des acides aminés dérivés de la voie de biosynthèse du glutamate.
Isomères
[modifier | modifier le code]Il existe en fait 8 formes d'hydroxyproline correspondant à deux paires d'énantiomères de deux isomères de position, la 3-hydroxyproline et la 4-hydroxyproline, partageant la même formule brute C5H9NO3, chacun des deux formant deux paires d'énantiomères, diastéréoisomères entre elles :
- (2R,3R)-3-hydroxyproline ;
- (2S,3S)-3-hydroxyproline ;
- (2R,3S)-3-hydroxyproline ;
- (2S,3R)-3-hydroxyproline ;
- (2R,4R)-4-hydroxyproline ;
- (2S,4S)-4-hydroxyproline ;
- (2R,4S)-4-hydroxyproline ;
- (2S,4R)-4-hydroxyproline.
-
3-Hydroxyproline
-
4-Hydroxyproline
3-Hydroxyproline
[modifier | modifier le code]L'hydroxylation porte sur le troisième atome de carbone (le premier étant celui de la fonction acide carboxylique). Les carbone 2 et 3 sont chiraux, la 3-hydroxyproline existe donc sous la forme de deux paires d'énantiomères.
4-Hydroxyproline
[modifier | modifier le code]L'hydroxylation porte sur le quatrième atome de carbone (le premier étant celui de la fonction acide carboxylique). Les carbone 2 et 4 sont chiraux, la 4-hydroxyproline existe donc sous la forme de deux paires d'énantiomères.
-
(2S,4R)-4-Hydroxyproline
-
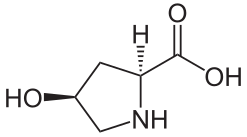
(2R,4S)-4-Hydroxyproline
-
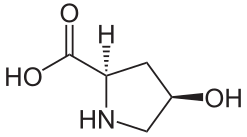
(2S,4S)-4-Hydroxyproline
-
(2R,4R)-4-Hydroxyproline
Biosynthèse
[modifier | modifier le code]L'hydroxyproline est présente dans l'alimentation.[réf. souhaitée] Mais, il n'existe pas d'ARNt capable d'accepter l'hydroxyproline, et donc de l'insérer dans une chaîne polypeptidique en cours de formation[2].
L'hydroxylation s'effectue de ce fait après que la proline a été intégrée à la chaîne polypeptidique. Cette réaction est catalysée par une enzyme : la prolyl hydroxylase (de la famille des peptidyl hydroxylases), et en présence de O2 (l'enzyme est donc une oxygénase), d'ascorbate, de Fe2+ et d'α-cétoglutarate.
Pour chaque molécule de proline hydroxylée, une molécule d'α-cétoglutarate est décarboxylée en succinate. Au cours de cette réaction, l'un des atomes du O2 est incorporé à la proline, l'autre au succinate.
Fonction
[modifier | modifier le code]La présence de la forme hydroxylée de la proline permet la formation de liaisons covalentes (réaction d'aldolisation) entre différentes chaînes polypeptidiques voisines. Cela a pour conséquence de rendre la structure plus résistante. Ainsi les fibres de collagène sont très résistantes à des forces de traction dans le sens de la longueur[3].
En outre, la présence d'hydroxyproline protège les protéines contre la digestion par les protéases.
Chaîne polypeptidique contenant de l'hydroxyproline
[modifier | modifier le code]- Le tropocollagène, chaîne polypeptidique dont l'assemblage forme le collagène.
Notes et références
[modifier | modifier le code]- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Kelly L. Gorres et Ronald T. Raines, « Prolyl 4-hydroxylase », Critical Reviews in Biochemistry and Molecular Biology, vol. 45, no 2, , p. 106–124 (ISSN 1549-7798, PMID 20199358, PMCID PMC2841224, DOI 10.3109/10409231003627991, lire en ligne, consulté le )
- ↑ Brinckmann, Jürgen., Notbohm, Holger. et Müller, P. K., Collagen : primer in structure, processing, and assembly, Springer, , 252 p. (ISBN 978-3-540-23272-8, OCLC 60606926, lire en ligne)