Docteur en Pharmacie, c’est avec ma casquette d’ancienne directrice réglementaire internationale dans l’industrie pharmaceutique que j’ai souhaité éclairer votre compréhension des données sources officielles relatives aux 4 vaccins COVID-19.
Le fichier complet de cet article téléchargeable en format pdf se trouve ici.
J’ai été passionnée par mon métier d’analyse terrain des textes de loi pour savoir comment développer au mieux les médicaments et travailler en synergie avec les différentes fonctions de l’entreprise et les autorités de santé en France et à l’international (jusqu’à 83 pays).
Au 30 Mars 2021, les laboratoires Pfizer, Moderna, Astra Zeneca et Janssen, ont obtenu une autorisation de mise sur le marché (AMM) conditionnelle pour 4 vaccins COVID-19 (entre décembre 2020 et mars 2021).
Pour bien comprendre la situation actuelle, il est nécessaire d’accéder aux données sources qui sont difficilement identifiables par quelqu’un qui ne travaille pas dans le domaine. L’objectif de cet article est donc de présenter un éclairage des informations publiques pour ces 4 vaccins COVID-19 avec un renvoi vers chaque source pour permettre d’en valider l’authenticité.
Vous trouverez donc dans cet article les liens vers les documents officiels des Autorisations de Mises sur le Marché (AMM) et les résumés des études scientifiques tels qu’évalués par l’Agence Européenne du Médicament (EMA).
Tout d’abord, je tiens à préciser que je n’ai aucun conflit d’intérêt avec l’industrie pharmaceutique.
1. Avant tout, il est important de savoir ce qu’est une Autorisation de Mise sur le Marché conditionnelle :
Une Autorisation de Mise sur le Marché (= AMM) est octroyée quand un produit a prouvé sa qualité, son efficacité et sa sécurité avec un rapport bénéfice/risque positif (c’est-à-dire qu’il présente plus de bénéfices que de risques). L’obtention de l’AMM est la condition indispensable pour vendre un médicament, dont les vaccins.
L’ensemble des études déposé lors de la demande d’AMM est résumé dans l’EPAR (= European Public Assessment Report = Rapport d’Évaluation Européen Publique). Ce dernier est publié sur le site de l’Agence Européenne du Médicament (EMA). Les études planifiées non encore réalisées y figurent également. Ce planning, qui s’étale de 2021 à 2025 selon les vaccins COVID-19, est défini dans les annexes de l’AMM conditionnelle et dans l’EPAR.
L’AMM est octroyée à un laboratoire appelé titulaire d’AMM (= Marketing Authorisation Holder = MAH, en anglais). Les AMM conditionnelles ont été obtenues sur la base de données qualité, cliniques et non cliniques issues de « tests sur les vaccins et/ou de littératures bibliographiques ». Les données de littératures bibliographiques sont des études publiées dans des journaux scientifiques reconnus, rédigées par des équipes extérieures ou non à celles du laboratoire demandeur de l’AMM.
L’AMM européenne, obtenue par la procédure centralisée accélérée, permet une mise sur le marché simultanée dans les 30 pays suivants (Union Européenne et Association européenne de libre-échange) : Allemagne, Autriche, Belgique, Bulgarie, Chypre, Croatie, Danemark, Espagne, Estonie, Finlande, France, Grèce, Hongrie, Irlande, Islande, Italie, Lettonie, Liechtenstein, Lituanie, Luxembourg, Malte, Norvège, Pays-Bas, Pologne, Portugal, Roumanie, Slovaquie, Slovénie, Suède, Tchéquie.
À titre d’exemple, l’EPAR de Pfizer (pages 67 et 114) du 19 février 2021, vaccin COVID-19 le plus administré à ce jour avec l’indication de traitement la plus large (individus au-dessus de 16 ans) mentionne que l’étude clinique principale dite pivotale, est une étude de phase 1/2/3, encore en cours.
| Données originelles de l’EPAR en anglais | Traduction en français par le logiciel Deepl |
| Study C4951001: A Phase 1/2/3, Placebo-Controlled, Randomized, Observer-Blind, Dose-Finding Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of SARS-COV-2 RNA Vaccine Candidates Against COVID-19 in Healthy Individuals
The safety evaluation is based on one ongoing Phase 2/3 study that at the time of data cut-off (14-Nov-20) included 43,448 subjects who received either two doses of BNT162b2 30μg (n=21 720) or placebo (n=21 728). Overall, the reported reactogenicity profile are in line with any authorised vaccine. In addition, the frequency of reported AEs and SAEs were low. The emerging safety profile is presently considered favourable. Long term safety data, interaction with other vaccines, data on use in pregnancy and other subgroups (e.g. frail subjects, or subjects with pre-existing autoimmune diseases) are missing at this stage. The lack of long-term follow up renders the data provided non-comprehensive. Therefore, the delivery of the final C4951001 study report, including a 2-year follow up of the studied population, is classified as a specific obligation in the context of a conditional marketing authorisation. The plan for the generation of further safety data post authorisation is described in the section below. |
Étude C4951001 : Étude de phase 1/2/3, contrôlée - placebo, randomisée, observateur - en aveugle, détermination de la dose, visant à évaluer l'innocuité, la tolérabilité, l'immunogénicité et l'efficacité des candidats vaccins à base d'ARN du SRAS-COV-2 contre le COVID-19 chez des individus sains. (page 67)
L'évaluation de la sécurité est basée sur une étude de phase 2/3 en cours qui, au moment de la clôture des données (14-Nov-20), comprenait 43 448 sujets ayant reçu soit deux doses de 30μg (n=21 720), soit un placebo (n=21 728). Globalement, le profil de réactogénicité rapporté est conforme à tout vaccin autorisé. En outre, la fréquence des effets indésirables et des effets secondaires graves signalés était faible. Le profil de sécurité émergent est actuellement considéré comme favorable. Les données de sécurité à long terme, l'interaction avec d'autres vaccins, les données sur l'utilisation pendant la grossesse et d'autres sous-groupes (par exemple, les sujets fragiles ou les sujets atteints de maladies auto-immunes préexistantes) manquent à ce stade. L'absence de suivi à long terme rend les données fournies non exhaustives. Par conséquent, la remise du rapport final de l'étude C4951001, comprenant un suivi de 2 ans de la population étudiée, est classée comme une obligation spécifique dans le contexte d'une autorisation de mise sur le marché conditionnelle. Le plan pour la génération de données de sécurité supplémentaires après l'autorisation est décrit dans la section ci-dessous. |
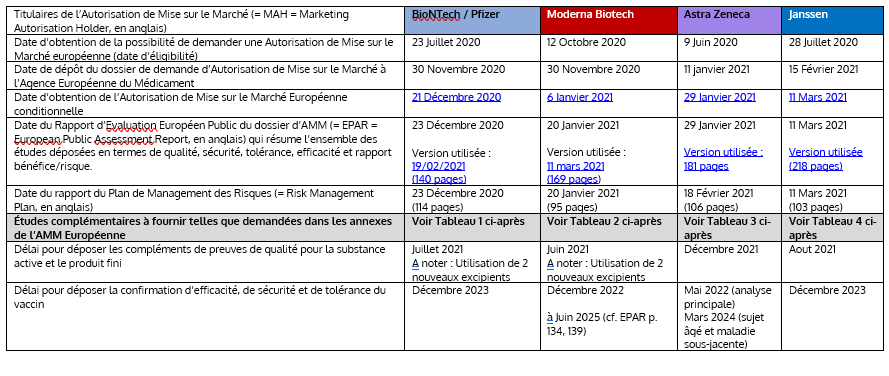
2. Tableau résumé des données des 4 AMM conditionnelles des vaccins COVID-19 publiées sur le site de l’EMA:
Il est nécessaire d’avoir une visibilité sur le déroulé de la procédure d’enregistrement et les études encore à fournir. Le tableau ci-dessous reprend les différentes données officielles publiques sur le site de l’EMA : Ces données ont été extraites des textes officiels à la date du 22 Mars 2021 (Les textes soulignés renvoient aux liens correspondants sur le site officiel de l’EMA et l’ensemble des liens est récapitulé à la fin de ce document).
| Titulaires de l’Autorisation de Mise sur le Marché (= MAH = Marketing Autorisation Holder, en anglais) | BioNTech / Pfizer | Moderna Biotech | Astra Zeneca | Janssen |
| Date d’obtention de la possibilité de demander une Autorisation de Mise sur le Marché européenne (date d’éligibilité) | 23 Juillet 2020 | 12 Octobre 2020 | 9 Juin 2020 | 28 Juillet 2020 |
| Date de dépôt du dossier de demande d’Autorisation de Mise sur le Marché à l’Agence Européenne du Médicament | 30 Novembre 2020 | 30 Novembre 2020 | 11 Janvier 2021 | 15 Février 2021 |
| Date d’obtention de l’Autorisation de Mise sur le Marché Européenne conditionnelle | 21 Décembre 2020 | 6 Janvier 2021 | 29 Janvier 2021 | 11 Mars 2021 |
| Date du Rapport d’Evaluation Européen Public du dossier d’AMM (= EPAR = European Public Assessment Report, en anglais) qui résume l’ensemble des études déposées en termes de qualité, sécurité, tolérance, efficacité et rapport bénéfice/risque. | 23 Décembre 2020
Version utilisée : |
20 Janvier 2021
Version utilisée : |
29 Janvier 2021 | 11 Mars 2021 |
| Date du rapport du Plan de Management des Risques (= Risk Management Plan, en anglais) | 23 Décembre 2020 (114 pages) |
20 Janvier 2021 (95 pages) |
18 Février 2021 (106 pages) |
11 Mars 2021 (103 pages) |
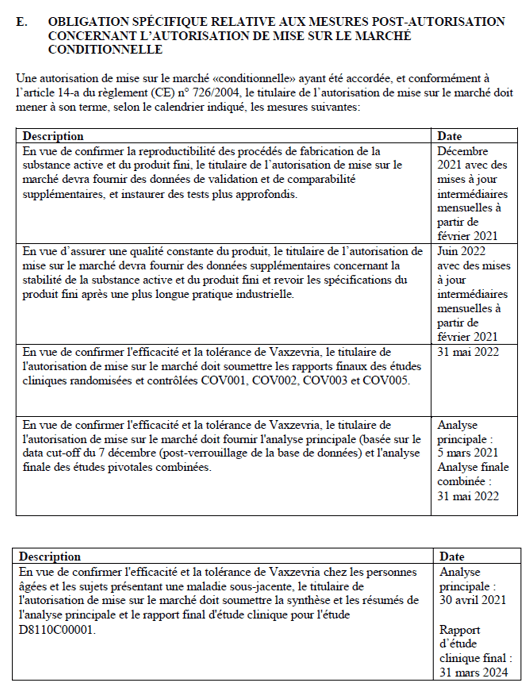
| Études complémentaires à fournir telles que demandées dans les annexes de l’AMM Européenne | Voir Tableau 1 ci-après | Voir Tableau 2 ci-après | Voir Tableau 3 ci-après | Voir Tableau 4 ci-après |
| Délai pour déposer les compléments de preuves de qualité pour la substance active et le produit fini | Juillet 2021
A noter : Utilisation de 2 nouveaux excipients |
Juin 2021
A noter : Utilisation de 2 nouveaux excipients |
Décembre 2021 | Aout 2021 |
| Délai pour déposer la confirmation d’efficacité, de sécurité et de tolérance du vaccin | Décembre 2023 | Décembre 2022
à Juin 2025 (cf. EPAR p. 134, 139) |
Mai 2022 (analyse principale)
Mars 2024 (sujet âgé et maladie sous-jacente) |
Décembre 2023 |
3. De l’analyse de ces données publiques, il en ressort que :
- Ces vaccins ont reçu une Autorisation de Mise sur le Marché conditionnelle, valide un an au lieu des 5 ans pour les AMM standards. Les études en cours et planifiées doivent être finalisées pour l’obtention de l’AMM standard.
- Les essais cliniques, même s’ils ont été planifiés, ne sont pas terminés et certains n’ont pas encore commencé. Selon les vaccins, les échéances définitives sont prévues entre 2022 et 2025 (cf. tableau ci-dessus).
- Aucune donnée n’est disponible concernant l’interchangeabilité d’un vaccin COVID-19 d’un laboratoire avec les autres vaccins COVID-19 des autres laboratoires pour compléter le schéma de vaccination.
- L’utilisation du vaccin est indiquée à partir de 18 ans, sauf pour celui de Pfizer indiqué à partir de 16 ans.
- « La sécurité et l’efficacité des vaccins chez l’enfant et les adolescents âgés de moins de 18 ans n’ont pas encore été établies ». C’est le cas de Moderna, Astra-Zeneca et Janssen pour lesquels « aucune donnée n’est disponible». Idem dans le cas de Pfizer « chez les enfants et adolescents âgés de moins de 16 ans avec des données disponibles limitées ».
- Les données sur les femmes enceintes sont très partielles(critères d’exclusion des essais cliniques): pas ou peu de données de sécurité et d’efficacité sont connues à ce jour. ( Tableau 5 à titre d’exemple). La vaccination chez la femme enceinte ne peut être envisagée qu’au cas par cas. Pour les 3 vaccins Pfizer, Moderna, Janssen, la notice scientifique représentée par l’annexe I de l’AMM (résumé des caractéristiques du produit) indique qu’il « existe des données limitées sur l’utilisation du vaccin chez la femme enceinte. Les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères directs ou indirects sur la gestation, le développement embryonnaire/foetal, la mise bas ou le développement postnatal (voir rubrique 5.3 de l’annexe I de l’AMM). L’utilisation chez la femme enceinte doit être envisagée seulement si les bénéfices potentiels l’emportent sur les risques potentiels pour la mère et le foetus. » Aucune information similaire n’est mentionnée dans la notice d’Astra Zeneca : « Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin, votre pharmacien ou votre infirmier/ère avant de recevoir ce vaccin. »
- D’expérience, tout médicament mis sur le marché permet de mettre en visibilité des effets secondaires à grande échelle pas ou peu apparus dans les essais cliniques. Ceci signifie concrètement que des effets secondaires liés à la vaccination peuvent apparaître dans le temps (ce qui explique sans doute l’épisode Astra-Zeneca de mi-Mars 2021).
- L’AMM conditionnelle des vaccins selon la procédure européenne centralisée accélérée a été « accordée dans l'intérêt de la santé publique pour répondre à un besoin médical non satisfait».
Certains professeurs et médecins ont déclaré avoir constaté sur le terrain l’efficacité de traitements constitués d’associations médicamenteuses : antiviraux, antibiotiques, vitamines, compléments alimentaires, etc…. On sait le débat qui existe depuis quant à la différence de traitement entre des publications scientifiques qui pourraient être réglementairement acceptables dans le cadre d’une demande d’AMM conditionnelle pour de nouveaux vaccins, et être inacceptables pour l’utilisation de médicaments utilisés depuis de nombreuses années (cf. hydroxychloroquine)... Aujourd’hui encore la question demeure débattue.
Conclusion
En conclusion, l’AMM conditionnelle européenne obtenue dans 30 pays sur la base d’études incomplètes et/ou bibliographiques et d’études à venir, permet de comprendre en quoi l’administration du vaccin COVID-19 en 2021 est une procédure d’investigation à grande échelle.
Les personnes qui se font vacciner dans le cadre d’études encore en cours ou à venir (tels que les enfants, les femmes enceintes, et toutes les populations ciblées dans les tableaux présentés dans les EPAR) entrent donc dans des protocoles de recherche et d’expérimentation.
Avant de se faire vacciner, chacun est en droit de demander toutes les informations utiles à son consentement éclairé, y compris la notice du médicament (cf. annexes de l’Autorisation de Mise sur le Marché, liens fournis en annexe 6 en fin de ce documents). De plus, un principe de précaution doit primer avant même l’obtention dudit consentement.
Aujourd’hui j’ai orienté mon activité professionnelle vers l’accompagnement et la formation en Santé et Qualité de Vie des personnes et des organisations selon leur raison d’être, et je suis très attachée au respect de chacun. En tant que Docteur en Pharmacie et Psychologue du Travail holistique (CV en annexe), j’associe les sciences rationnelles aux approches de la conscience sous toutes ses formes.
Avec l’appui de ces sources documentaires et réglementaires, j’ai souhaité vous permettre de trouver par vous-même la bonne compréhension des textes et ainsi vous apporter un éclairage sur ces nouveaux vaccins.
Dr. Catherine FRADE, Curriculum vitae ici.
Docteur en Pharmacie, Psychologue & Clinicienne du travail
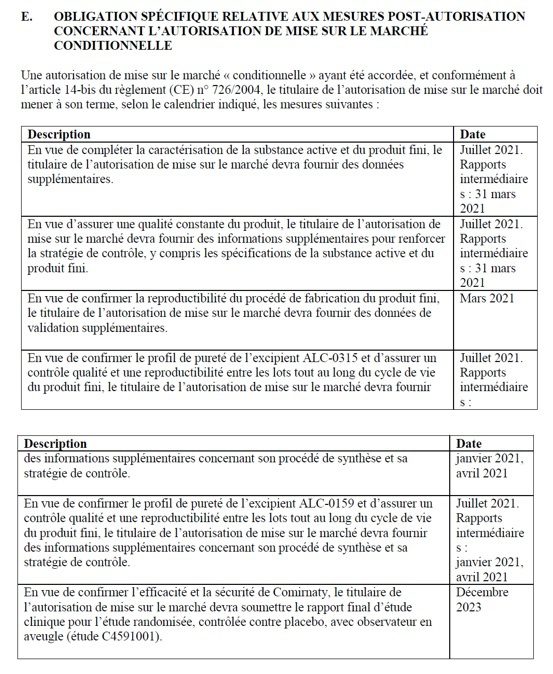
Tableau 1 : Annexe IIE de l’AMM Pfizer, pages 18 et 19
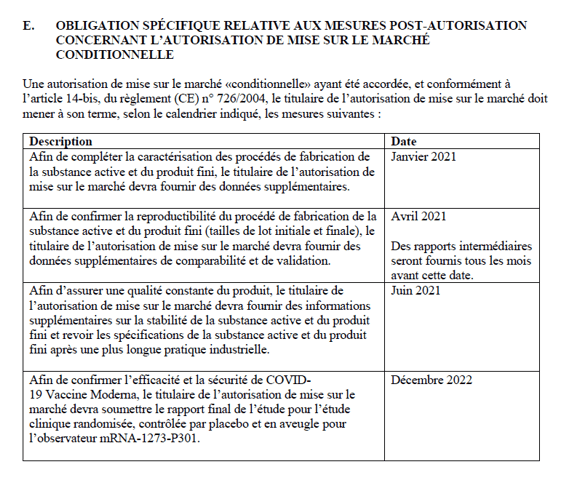
Tableau 2 : Annexe IIE de l’AMM Moderna, page 15
Tableau 3 : Annexe IIE de l’AMM Astra Zeneca , pages 14 et 15
Tableau 4 : Annexe IIE de l’AMM Janssen, page 18
Tableau 5 : Données Grossesse issue de l’EPAR de Pfizer, à titre d’exemple
Le terme « pregnant » (enceinte) ou « pregnancy » (grossesse) est apparu dans 10 pages du rapport EPAR émis par l’EMA. Les phrases exactes du rapport sont reprises en l’état dans ce tableau.
| Extraits de l’EPAR Pfizer – texte original en anglais | Traduction en français par le logiciel Deepl |
| Page 14. A study in pregnant women is also planned in the EU. A Post-Approval Active Surveillance Safety Study to Monitor Real-World Safety of Comirnaty (Study C4591010) will be conducted in the EU using primary data collection that monitors a cohort of vaccinees and evaluates risk of AESIs (adverse event of special interest) | Page 14. Une étude chez les femmes enceintes est également prévue dans l'UE. Une étude de sécurité de surveillance active post-approbation visant à surveiller la sécurité de Comirnaty dans le monde réel (étude C4591010) sera menée dans l'Union Européenne en utilisant la collecte de données primaires qui surveille une cohorte de vaccinés et évalue le risque d’événements indésirables présentant un intérêt particulier. |
| Page 68. 2.5.2. Main study, Title of study : Study C4951001: A Phase 1/2/3, Placebo-Controlled, Randomized, Observer-Blind, Dose-Finding Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of SARS-COV-2 RNA Vaccine Candidates Against COVID-19 in Healthy Individuals
Methods : Study Participants - exclusion criteria - Women who are pregnant or breastfeeding. |
Page 68. 2.5.2. Étude principale, Titre de l'étude : Étude C4951001 : Une étude de phase 1/2/3, contrôlée-placebo, randomisée, en aveugle - observateur et détermination de la dose pour évaluer l'innocuité, la tolérabilité, l'immunogénicité et l'efficacité des candidats vaccins ARN SRAS-COV-2 contre COVID-19 chez des individus sains.
Méthodes : Participants à l'étude - critères d'exclusion - Femmes enceintes ou allaitantes. |
| Page 93. Immunocompromised subjects and pregnant or breastfeeding women were excluded from the study. | Page 93. Les sujets immunodéprimés et les femmes enceintes ou allaitantes ont été exclus de l'étude. |
| Page 109. At the time of the data cut-off in the Phase 2/3 study (14 Nov 2020), a total of 23 participants had reported pregnancies in the safety database, including 9 participants who withdrew from the vaccination period of the study due to pregnancy. These participants are being followed for pregnancy outcomes. Thus, data on pregnancy are very limited at this stage. | Page 109 : Au moment de la clôture des données de l'étude de phase 2/3 (14 nov 2020), un total de 23 participantes avait déclaré des grossesses dans la base de données de sécurité, dont 9 participantes qui se sont retirées de la période de vaccination de l'étude en raison de leur grossesse. Ces participantes sont suivies pour les résultats de la grossesse. Les données sur la grossesse sont donc très limitées à ce stade. |
| Page 113. 23 participants reported pregnancies in the safety database, nine of them were withdrawn from the study due to the pregnancy status. These participants will be followed up for pregnancy outcomes. | Page 113. 23 participantes ont déclaré des grossesses dans la base de données de sécurité, dont 9 ont été retirées de l'étude en raison de leur état de grossesse. Ces participantes seront suivies pour les résultats de la grossesse. |
| Page 114. clinical safety : Long term safety data, interaction with other vaccines, data on use in pregnancy and other subgroups (e.g. frail subjects, or subjects with pre-existing autoimmune diseases) are missing at this stage. | Page 114. sécurité clinique : Les données de sécurité à long terme, l'interaction avec d'autres vaccins, les données sur l'utilisation pendant la grossesse et d'autres sous-groupes (par exemple, les sujets fragiles ou les sujets atteints de maladies auto-immunes préexistantes) sont manquantes à ce stade. |
| Page 115. safety information : missing information = Use during pregnancy and while breast feeding | Page 115. informations de sécurité : informations manquantes = Utilisation pendant la grossesse et l'allaitement. |
| Page 119. atypical COVID-19 in a cohort of people within the Department of Defense Healthcare System. Pour decembre 2023
|
Page 119. COVID-19 atypique dans une cohorte (= groupe) de personnes au sein du Department of Defense Healthcare System. Pour décembre 2023 |
| Page 120. Study (study short name, and title) Status (planned/on-going) : C4591015 Planned
Summary of Objectives Planned clinical study to assess safety and immunogenicity in pregnant women who receive COVID-19 mRNA vaccine. Safety and immunogenicity of COVID-19 mRNA vaccine in pregnant women Safety concerns addressed : Use in pregnancy and while breast feeding. Protocol draft submission: 28-Feb-2021 Final CSR (Clinical study report) submission: 30-Apr-2023
|
Page 120. Étude (nom court et titre de l'étude) Statut (prévu/en cours) : C4591015 - étude planifiée (non encore réalisée)
Résumé des objectifs : Étude clinique planifiée pour évaluer la sécurité et l'immunogénicité chez les femmes enceintes qui reçoivent le vaccin COVID-19 mRNA. Sécurité et immunogénicité du vaccin à ARNm COVID-19 chez les femmes enceintes. Problèmes de sécurité abordés : Utilisation pendant la grossesse et l'allaitement. Soumission du projet de protocole : 28-Feb-2021 Soumission finale du rapport d’étude clinique: 30-Avr-2023 |
| Page 120. Study (study short name, and title) Status (planned/on-going) : ACCESS/VAC4EU
Planned Summary of Objectives Assessment of occurrence of safety events of interest, including severe or atypical COVID-19 in real-world use of COVID-19 mRNA vaccine. Safety concerns addressed : Anaphylaxis AESI-based safety events of interest including vaccine associated enhanced disease Use in pregnancy Use in immunocompromised patients Use in frail patients with co-morbidities (e.g, chronic obstructive pulmonary disease (COPD), diabetes, chronic neurological disease, cardiovascular disorders) Use in patients with autoimmune or inflammatory disorders Protocol draft submission: 28-Feb-2021 Final CSR submission: 31-Jan-2024
|
Page 120. Étude (nom court et titre de l'étude) Statut (prévu/en cours) : ACCESS/VAC4EU planifiée (non encore réalisée)
Résumé des objectifs Évaluation de l'occurrence des événements de sécurité d'intérêt, y compris les COVID-19 sévères ou atypiques dans l'utilisation réelle du vaccin à ARNm COVID-19. Problèmes de sécurité abordés : Anaphylaxie Événements de sécurité d'intérêt basés sur l’événements indésirables présentant un intérêt particulier, y compris les maladies renforcées associées au vaccin. Utilisation pendant la grossesse Utilisation chez les patients immunodéprimés Utilisation chez les patients fragiles présentant des comorbidités (par exemple, maladie pulmonaire obstructive chronique (MPOC), diabète, maladie neurologique chronique, troubles cardiovasculaires) Utilisation chez les patients souffrant de troubles auto-immuns ou inflammatoires. Soumission du projet de protocole : 28 février 2021 Soumission finale du rapport d’étude clinique: 31-Jan-2024 |
| Page 136. Benefit-risk assessment and discussion
3.7.1. Importance of favourable and unfavourable effects There are no data on use in pregnant women, but a protective effect is anticipated. In the light of the reassuring data from the DART study, noting that pregnancy as such is a risk factor for severe COVID-19, and that pregnant women may additionally belong to other risk groups, vaccination may be considered on a case by case basis. |
Page 136. Evaluation et discussion des bénéfices et des risques
3.7.1. Importance des effets favorables et défavorables Il n'existe pas de données sur l'utilisation chez la femme enceinte, mais un effet protecteur est attendu. A la lumière des données rassurantes de l'étude DART, en notant que la grossesse en tant que telle est un facteur de risque de COVID-19 sévère, et que les femmes enceintes peuvent en plus appartenir à d'autres groupes à risque, la vaccination peut être envisagée au cas par cas. |
Annexe 6. Références disponibles sur internet (liste non exhaustive)
Sur ce sujet, il existe un grand nombre de documents fort intéressants:
- Agence européenne des médicaments (EMA) : https://europa.eu/european-union/about-eu/agencies/ema_fr
- Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) : https://ansm.sante.fr/qui-sommes-nous/
- Questions-réponses: Autorisation de mise sur le marché conditionnelle de vaccins contre la COVID-19 dans l'UE : https://ec.europa.eu/commission/presscorner/detail/fr/QANDA_20_2390
- https://www.ema.europa.eu/en/news/meeting-highlights-pharmacovigilance-risk-assessment-committee-prac-8-11-march-2021
Documents
Informations disponibles en accès libre sur EMA
Pfizer
https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty
Moderna
https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-moderna
Astra-Zeneca
https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-astrazeneca
Janssen
https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-janssen
Annexes de l’AMM
https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_fr.pdf
https://www.ema.europa.eu/en/documents/product-information/covid-19-vaccine-moderna-epar-product-information_fr.pdf
https://www.ema.europa.eu/en/documents/product-information/vaxzevria-previously-covid-19-vaccine-astrazeneca-epar-product-information_fr.pdf
https://www.ema.europa.eu/en/documents/product-information/covid-19-vaccine-janssen-epar-product-information_fr.pdf
Rapport d’évaluation EPAR – revue médicale
https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf
https://www.ema.europa.eu/en/documents/assessment-report/covid-19-vaccine-moderna-epar-public-assessment-report_en.pdf
https://www.ema.europa.eu/en/documents/overview/covid-19-vaccine-astrazeneca-epar-medicine-overview_fr.pdf
https://www.ema.europa.eu/en/documents/assessment-report/covid-19-vaccine-janssen-epar-public-assessment-report_en.pdf
https://www.ema.europa.eu/en/documents/smop-initial/chmp-summary-positive-opinion-comirnaty_en.pdf
https://www.ema.europa.eu/en/documents/smop-initial/chmp-summary-positive-opinion-covid-19-vaccine-moderna_en.pdf
https://www.ema.europa.eu/en/documents/smop-initial/chmp-summary-positive-opinion-covid-19-vaccine-astrazeneca_en.pdf
https://www.ema.europa.eu/en/documents/smop-initial/chmp-summary-positive-opinion-covid-19-vaccine-janssen_en.pdf
Plan de management des risques
https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf
https://www.ema.europa.eu/en/documents/rmp-summary/covid-19-vaccine-moderna-epar-risk-management-plan_en.pdf
https://www.ema.europa.eu/en/documents/rmp-summary/covid-19-vaccine-astrazeneca-epar-risk-management-plan_en.pdf
https://www.ema.europa.eu/documents/rmp-summary/covid-19-vaccine-janssen-epar-risk-management-plan_en.pdf
Présentations autorisées
https://www.ema.europa.eu/en/documents/all-authorised-presentations/comirnaty-epar-all-authorised-presentations_fr.pdf
https://www.ema.europa.eu/en/documents/all-authorised-presentations/covid-19-vaccine-moderna-epar-all-authorised-presentations_fr.pdf
https://www.ema.europa.eu/en/documents/all-authorised-presentations/covid-19-vaccine-janssen-epar-all-authorised-presentations_fr.pdf
Cet article a été publié ici
Cet article a été posté uniquement à quatre endroits :
- Sur mon blog ici : https://bit.ly/3wjTGYB
- Linked in en français ou Linked in en anglais
- Repris en partie par le CTIAP de l’Hopital de Cholet le 2 avril 2021, qui a rajouté ses conclusions
- repris dans un éclairage des impacts juridiques rédigé par Nathalie Tisseyre-Boinet




merci pour votre article que je poste sur mon blog.