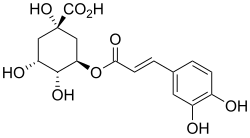
Acide chlorogénique
| Acide chlorogénique, (trans-5-O-caféylquinique) | |
| |
 5-O-Caféyl-D-quinate |
|
| Identification | |
|---|---|
| Nom UICPA | acide 3-[[3-(3,4-dihydroxyphenyl)-1-oxo-2-propenyl]oxy]-1,4,5-trihydroxycyclohexanecarboxylique |
| Synonymes |
acide 5-O-(3,4-dihydroxycinnamoyl)-L-quinique |
| No CAS | trans |
| No CE | 206-325-6 |
| PubChem | 9476 |
| SMILES | |
| Apparence | Solide blanc inodore |
| Propriétés chimiques | |
| Formule | C16H18O9 [Isomères] |
| Masse molaire[2] | 354,308 7 ± 0,016 8 g/mol C 54,24 %, H 5,12 %, O 40,64 %, |
| pKa | 2,66 (27 °C)[1] |
| Propriétés physiques | |
| T° fusion | 207 à 209 °C |
| Solubilité | 40 g·L-1 (eau, 25 °C)[1] |
| Masse volumique | 1,28 g·cm-3 |
| Précautions | |
| NFPA 704 | |
| Directive 67/548/EEC | |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acide chlorogénique est un acide-phénol, ester de l'acide caféique et de l'acide (L)-quinique[3] ; on le retrouve ainsi sous les appellations de trans-5-O-caféoyl-D-quinate, ou acide caféylquinique, ou 5-ACQ (ou 5-CQA en anglais). Il est produit par les plantes, comme le café et la pomme de terre, et il est chez certaines d'entre elles le précurseur de l'acide dicaféylquinique ou cynarine. Comme tous les composés polyphénoliques, il a une activité antioxydante.
Le terme acides chlorogéniques désigne aussi une famille d'acides de structure chimique similaire à l'acide chlorogénique, regroupant les composés formés par un (ou plusieurs) acide hydroxycinnamique conjugué avec l'acide quinique.
Étymologie : le terme chlorogénique a été forgé à partir du grec khloros χλωρός « vert », genos γένος « naissance » suffixe -ique, en raison de la production de produits de couleur verte lorsque ces acides chlorogéniques s'oxydent.
Distribution chez les plantes alimentaires
[modifier | modifier le code]L'acide chlorogénique (5-ACQ, stricto sensu) est l'un des principaux composés phénoliques du café, également trouvé chez certaines plantes où on peut l'isoler dans les feuilles ou fruits[4].
Dans notre alimentation, le café est la source principale d'acide chlorogénique. Il représente de 5 à 10 % du poids des grains de café verts. Un litre de café filtre fournit de 500 à 800 mg d'acide chlorogénique, correspondant à 250-400 mg d'acide caféique.
On le trouve aussi en quantité importante dans l'artichaut et les endives mais quand même en quantité moindre que dans les grains de café non torréfiés (5-10 % soit 5000 à 10 000 mg·100g-1, non répertoriés dans le tableau). Une teneur élevée (1 245 mg·100g-1) se trouve dans les fleurs de chèvrefeuille du Japon (Lonicera japonica) qui une fois séchées sont utilisées dans la médecine traditionnelle chinoise.
| Plantes alimentaires riches en acide chlorogénique (acide 5-caféylquinique) en mg/100 g de matière fraiche, d'après et Phenol Explorer[5] | ||
| Forme consommée | Nom scientifique de la plante | Teneur |
|---|---|---|
| Graines de tournesol, farine | Helianthus annuus | 454,48 mg·100g-1 |
| Artichaut cru | Cynara scolymus | 202,23 mg·100g-1 |
| Grande bardane, crue | Arctium lappa | 126,76 mg·100g-1 |
| Boisson de café décaféiné, filtre | Coffea sp | 116,85 mg·100ml-1 |
| Endive, verte, crue | Cichorium intybus L. var. foliosum | 108,88 mg·100g-1 |
| Boisson de café Robusta, filtre | Coffea canephora | 75,80 mg·100ml-1 |
| Nèfle du Japon | Eriobotrya japonica | 54,75 mg·100g-1 |
| Boisson de café Arabica, filtre | Coffea arabica | 43,09 mg·100ml-1 |
| Pruneau | Prunus domestica | 38,79 mg·100g-1 |
| Menthe douce, séchée | Mentha spicata | 31,00 mg·100g-1 |
| Pomme de terre, crue | Solanum tuberosum | 26,73 mg·100g-1 |
| Cidre, pomme | Malus pumila | 21,45 mg·100ml-1 |
| Pur jus de pruneau | Prunus domestica | 20,35 mg·100ml-1 |
| Carotte crue | Daucus carota spp sativus | 8,88 mg·100g-1 |
| Pur jus de pomme | Malus pumila | 7,01 mg·100ml-1 |
| Thé vert, infusion | Camellia sinensis | 2,30 mg·100ml-1 |
| Vin blanc | Vitis vinifera | 0,10 mg·100ml-1 |
Absorption
[modifier | modifier le code]Les mesures[6] (Olthof et al 2001) d'absorption de l'acide chlorogénique 5-ACQ ont été faites sur des patients ayant une iléostomie (sans côlon), dont les matières peuvent être récupérées avant l'entrée dans le côlon. Après avoir consommé 2,8 mmol d'acide chlorogénique, en moyenne 33 % était absorbé dans l'intestin grêle. Seules quelques traces de métabolites de l'acide chlorogénique (sous forme d'acides caféique et férulique) se retrouvent dans les urines.
Par contre, lorsque deux ans plus tard, Olthof et al.[7] (2003) ont poursuivi leur étude avec des humains ayant un côlon intact, ils ont pu montrer que la moitié de l'acide chlorogénique ingéré se retrouvait dans les urines sous forme d'acide hippurique. On suppose que chaque molécule d'acide chlorogénique peut donner deux molécules d'acide hippurique. On ne retrouve dans l'urine que 1,7 % de l'acide chlorogénique ingérée sous forme intacte.
La différence entre les sujets avec et sans côlon peut se comprendre si on suppose que l'acide chlorogénique est mal absorbé au niveau de l'intestin grêle mais devient disponible après avoir été hydrolysé par la microflore du côlon.
Les deux tiers de l'acide chlorogénique ingéré atteignent le côlon où ils sont hydrolysés par la microflore en acide caféique et acide quinique. Ceux-ci sont déhydroxylés par les bactéries avant d'être absorbés. L'acide benzoïque formé est ensuite conjugué avec la glycine et excrété dans l'urine sous forme d'acide hippurique.
L'acide chlorogénique est peu absorbé par le foie[8].
Activités pharmacologiques
[modifier | modifier le code]- Activité antioxydante
L'acide chlorogénique 5-ACQ, comme tous les polyphénols, possède des groupes hydroxyles phénoliques -OH, capables de prévenir ou ralentir l'oxydation des lipides. Dans une étude comparative avec l'acide caféique, l'effet de ces deux acides sur l'autoxydation du triacylglycérol a été étudié par Marinova et al.[9]. Il a été montré qu'à la concentration de 2,8 10-4 M, ces deux acides avaient pratiquement la même activité mais qu'à des concentrations plus élevées, l'acide caféique était plus efficace.
Une étude in vitro a aussi montré que l'acide chlorogénique protégeait contre l'oxydation du LDL, une première étape dans la formation de la plaque d'athérome[10].
L'activité antioxydante de l'acide chlorogénique est bien établie par plusieurs études in vitro mais l'effet in vivo reste plus incertain car il est métabolisé en produits parfois moins actifs. C'est le cas de l'acide hippurique, son métabolite le plus important, dépourvu d'activité antioxydante car il n'a pas de groupe hydroxyle[7].
- Activités anxiolytiques, antidépresseurs
Quelques études ont suggéré un lien entre le stress oxydatif et l'anxiété[11]. L'effet anxiolytique de l'acide chlorogénique a été observé chez la souris soumise aux tests de transition lumière/obscurité, au labyrinthe en croix surélevé et à l'exploration libre. La dose élevée de 20 mg kg−1 d'acide chlorogénique[N 1] a le même effet anxiolytique que le diazépam à 1 mg kg−1, comparé au témoin, pour les souris soumises au test lumière/obscurité. Le test du labyrinthe en croix surélevé a permis d'explorer le rôle des récepteurs aux benzodiazépines (récepteurs du GABA). Les résultats suggèrent que l'activité anxiolytique de l'acide chlorogénique pourrait être liée à l'activation des récepteurs aux benzodiazépines.
- Diabète
L'acide chlorogénique retarde la résorption intestinale du glucose et donc son passage dans le sang[12],[13]. Il a été observé que le café accroît la production d'une hormone intestinale, l'incrétine GLP-1, en raison de l'effet inhibiteur de l'acide chlorogénique sur l'absorption du glucose. L'incrétine libérée dans le sang va stimuler la production pancréatique d'insuline.
Il pourrait peut-être jouer un rôle préventif dans l'apparition de diabète de type 2[14].
Des acides chlorogéniques ont aussi été testés chez l'animal (in vitro) pour inhiber l'hydrolyse irréversible de l'enzyme glucose-6-phosphatase. Ce mécanisme permet à l'acide chlorogénique de réduire la glycogénolyse hépatique (transformation du glycogène en glucose) et de réduire l'absorption de nouveau glucose. De plus, des études sur l'animal in vivo laissent penser que l'administration d'acide chlorogénique pourrait avoir des effets sur le pic hyperglycémique résultant de la glycogénolyse induit par l'administration de glucagon (hormone hyperglycémiante), avec réduction du taux de glucose sanguin et augmentation des concentrations de glucose-6-phosphate et glycogène à l'intérieur du foie[15].
- Activités antimutagènes, anticancéreuses
Applications industrielles et pharmaceutiques
[modifier | modifier le code]L'acide chlorogénique semble avoir des propriétés antivirales[16], antibactériennes[17] et antifongiques[18] avec une toxicité et des effets secondaires faibles et des propriétés ne conduisant pas à l'apparition de résistance microbienne.
Des usages potentiels pourraient concerner la pharmacie, mais aussi l'alimentation, des additifs alimentaires et cosmétiques.
Un acide chlorogénique est vendu sous la marque commerciale Svetol en Norvège et au Royaume-Uni comme additif alimentaire utilisé dans le café, des chewing-gums, et produits visant à faire perdre du poids[19],[20].
Dérivés
[modifier | modifier le code]La classe des acides chlorogéniques (ACG) regroupe les composés formés d'acides hydroxycinnamiques (acide caféique, férulique, para-coumarique, sinapique, diméthoxycinnamique) conjugués à l'acide quinique. Ils forment des mono-esters :
- acide caféylquinique (ACQ)
- acide férulylquinique (AFQ)
- acide p-coumarylquinique (APQ)
- acide sinapylquinique
- acide diméthoxycinnamylquinique
ou des di-esters :
- acide dicaféylquinique
- acide caféylférulylquinique
- acide diférulylquinique
- acide di-p-coumarylquinique
- acide diméthoxycinnamylquinique
Plusieurs formes isomériques se rencontrent dans la nature. Par exemple, pour les acides caféylquiniques (ACQ), on trouve les 3-ACQ, 4-ACQ, 5-ACQ (ou acide chlorogénique) suivant que la liaison se fait en position 3, 4 ou 5 sur les hydroxyles de l'acide quinique.
On rencontre aussi des composés formés de plusieurs acides hydroxycinnamiques conjugués avec un acide quinique, comme les acides 1,3-O-dicaféylquinique, 3,4-O-dicaféylquinique, 3,5-O-dicaféylquinique, etc., ou bien l'acide caféylférulylquinique. Le café contient toute la palette de ces composés.

De plus, les acides hydroxycinnamiques existent sous les isoformes[21] trans ou cis (comme l'acide cinnamique) et donnent en conjugaison avec l'acide quinique, des acides chlorogéniques trans et cis. Les feuilles de café plus exposées aux rayonnements UV sont proportionnellement plus riches en isomères cis que les cerises de café.
Notes
[modifier | modifier le code]- ↑ par injection intra-péritonéale, car l'acide chloroquinique est mal absorbé par l'intestin
Références
[modifier | modifier le code]- (en) ChemIDplus, « Chlorogenic acid - RN: 327-97-9 », sur chem.sis.nlm.nih.gov, U.S. National Library of Medicine (consulté le )
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Clifford, M. N., « Chlorogenic acids and other cinnamates – nature, occurrence and dietary burden. », Journal of the Science of Food and Agriculture, volume 79, 362–372, 1999 (DOI 10.1002)
- ↑ (en) Clifford, M. N. « Methods in Polyphenol Analysis », chap 14. The analysis and characterization of chlorogenic acids and other cinnamates, Éditeur : C. Santos-Buelga & G. Williamson (Eds.), pour la Royal Society of Chemistry, Cambridge, 2003, pages 314 à 337 (ISBN 978-0-85404-580-8)
- ↑ Phenol Explorer Database
- ↑ Olthof MR, Hollman PC, Katan MB., « Chlorogenic Acid and Caffeic Acid are absorbed in humans », The Journal of Nurition, vol. 131, no 1, , p. 66-71
- Margreet R. Olthof, Peter C. H. Hollman, Michel N.C.P. Buijsman, Johan M.M. van Amelsvoort and Martijn B. Katan, « Chlorogenic Acid, Quercetin-3-Rutinoside and Black Tea Phenols Are Extensively Metabolized in Humans », J. Nutr., vol. 133, no 6, , p. 1806-14
- ↑ Mateos R, Goya L, Bravo L., « Uptake and metabolism of hydroxycinnamic acids (chlorogenic, caffeic, and ferulic acids) by HepG2 cells as a model of the human liver. », J Agric Food Chem., vol. 54, no 23, , p. 8724-32
- ↑ Emma M.Marinova,A. Toneva, N. Yanishlieva, « Comparison of the antioxidative properties of caffeic and chlorogenic acids », Food Chemistry, vol. 114, , p. 1498-1502
- ↑ Gordon MH, Wishart K., « Effects of chlorogenic acid and bovine serum albumin on the oxidative stability of low density lipoproteins in vitro. », Journal of Agricultural and food chemistry, vol. 58, no 9,
- ↑ Bouayed J, Rammal H, Dicko A, Younos C, Soulimani R., « Chlorogenic acid, a polyphenol from Prunus domestica (Mirabelle), with coupled anxiolytic and antioxidant effects. », J Neurol Sci, vol. 262, nos 1-2,
- ↑ McCarty MF., « A chlorogenic acid-induced increase in GLP-1 production may mediate the impact of heavy coffee consumption on diabetes risk. », Medical Hypotheses, vol. 64, no 4, , p. 848-53
- ↑ (en) Johnston K. L. et Clifford, M.N.; Morgan, L.M., « Coffee acutely modifies gastrointestinal hormone secretion and glucose tolerance in humans: glycemic effects of chlorogenic acid and caffeine »., American Journal of Clinical Nutrition, Vol 79, Tome 4, pages 728–733, 2003, Voir ()
- ↑ (en) Paynter, Nina P. et Yeh, H.C.; Voutilainen, S.; Schmidt, M.I.; Heiss, G.; Folsom, A.R.; Brancati, F.L.; Kao, W. H. L., « Coffee and Sweetened Beverage Consumption and the Risk of Type 2 Diabetes Mellitus », dans le American Journal of Epidemiology, 2006, vol 164, tome 11, pages 1075–1084, publié par Oxford Journals ; (résumé) ; (DOI 10.1093/aje/kwj323)
- ↑ (en) Harding Anna, « Coffee can be good for you, experts say » Voir (accès le 2007-05-26)
- ↑ (en) Jassim S.A.A. et Naji, M.A. ; « Novel antiviral agents: a medicinal plant perspective », dans Journal of Applied Microbiology (volume 95, Issue 3, pages 412 à 427, 2003 (DOI 10.1046/j.1365-2672.2003.02026.x)
- ↑ (en) Sotillo, D.R. & Hadley, M.; Wolf-Hall, C. « Potato Peel Extract a Nonmutagenic Antioxidant with Potential Antimicrobial Activity », dans Journal of Food Science 1998 (vol 63, partie 5, page 907), DOI 10.1111/j.1365-2621.1998.tb17924.x
- ↑ (en) Bowels Bobby L & Miller, A.J. « Caffeic Acid Activity Against Clostridium botulinum Spores » dans le Journal of Food Science (1994, volume 59, partie 4, p 905), Blackwell Publishing DOI 10.1111/j.1365-2621.1994.tb08154.x
- ↑ (en) Ventures Energix, « Coffee Slender, How does it work. » Voir, vu le 2007-05-26
- ↑ (no) Ventures Energix, « Studier viser at Coffeeslender virker! » Voir (commercial ?) 2007-05-26
- ↑ Michael N.Clifford, Jo Kirkpatrick, Nikolai Kuhnert, Hajo Roozendaal, Paula Rodrigues Salgado, « LC-MS analysis of the cis isomers of chlorogenic acids », Food Chemistry, vol. 106,
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Artichaut
- Acide caféique
- Acide dicaféylquinique (cynarine)


